Бутан получение
Содержание:
- Разница между бутаном и изобутаном
- Использует
- Дегидрирование бутана
- Физико-технические свойства пропана и бутана
- Зачем смешивают пропан и бутан в автономной системе газоснабжения
- Химические свойства бутана:
- Что такое бутан?
- Бутан (вещество)
- Технические характеристики
- Технические характеристики
- Ссылки [ править ]
- Здоровье и безопасность окружающей среды
- Основные физико-химические свойства компонентов СУГ и продуктов их сгорания
- Чистый н-бутан
- О стране Бутан
- Главное отличие — бутан против изобутана
Разница между бутаном и изобутаном
Определение
Бутан: Бутан является углеводородом, который может встречаться в нескольких формах в виде изомеров.
изобутан: Изобутан является структурным изомером н-бутана.
Химическая структура
Бутан: Бутан представляет собой смесь линейных структур и разветвленных структур.
изобутан: Изобутан представляет собой по существу разветвленную структуру.
Точка кипения
Бутан: Точка кипения бутана составляет около 1оC.
изобутан: Температура кипения изобутана составляет около -11оC.
Бутан: Бутан имеет бензиноподобный запах.
изобутан: Изобутан не имеет запаха.
Заключение
Бутан и изобутан являются углеводородными соединениями, которые можно найти в сырой нефти в качестве второстепенных компонентов. Это небольшие алкановые соединения, которые называют парафиновой фракцией нефтепереработки. Хотя они имеют одинаковую химическую формулу и одинаковую молярную массу, они различаются по нескольким причинам. Основное различие между бутаном и изобутаном заключается в том, что бутан может быть линейной или разветвленной молекулой, тогда как изобутан по существу является разветвленной молекулой.
Использует
Большая часть бутадиена используется в синтетических каучуках для изготовления шин, прокладок и резинок.
Превращение бутадиена в синтетические каучуки называется полимеризацией — процессом, при котором маленькие молекулы (мономеры) соединяются в большие (полимеры). Простая полимеризация бутадиена дает полибутадиен , который является очень мягким, почти жидким материалом. Полимеризация бутадиена и других мономеров дает более ценные сополимеры . Полимеризация бутадиена и стирола и / или акрилонитрила , таких как акрилонитрил-бутадиенстирол (ABS), нитрил-бутадиен (NBR) и стирол-бутадиен (SBR). Эти сополимеры являются прочными и / или эластичными в зависимости от соотношения мономеров, используемых при их получении. SBR — это материал, наиболее часто используемый для производства автомобильных шин. Предшественники других синтетических каучуков получают из бутадиена. Один из них — хлоропрен .
Меньшие количества бутадиена используются для производства адипонитрила , предшественника некоторых нейлонов. Превращение бутадиена в адипонитрил влечет за собой добавление цианистого водорода к каждой из двойных связей в бутадиене. Процесс называется гидроцианированием .
Бутадиен используется для получения сульфолана в качестве растворителя .
Бутадиен также полезен в синтезе циклоалканов и циклоалкенов , поскольку он реагирует с двойными и тройными углерод-углеродными связями через реакции Дильса-Альдера . Наиболее широко используемые такие реакции включают реакции бутадиена с одной или двумя другими молекулами бутадиена, т. Е. Димеризацию и тримеризацию соответственно. Посредством димеризации бутадиен превращается в 4-винилциклогексен и циклооктадиен . Фактически, винилциклогексен — обычная примесь, которая накапливается при хранении бутадиена. Посредством тримеризации бутадиен превращается в циклододекатриен . В некоторых из этих процессов используются никельсодержащие или титансодержащие катализаторы.
Дегидрирование бутана
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
| Например, при дегидрировании бутана преимущественно образуются бутен-2 (бутилен) или бутин-2. |
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:
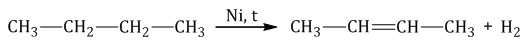
Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:

Физико-технические свойства пропана и бутана
Жидкие газы пропан и бутан являются органическими соединениями и относятся к группе насыщенных углеводородов (также называемых парафинами или алканами).
Химические формулы:
- C3H8 (пропан);
- C4H10 (бутан).
Скорость горения
Скорость сгорания или воспламенения – это скорость, которой может достичь сжиженный газ при смешивании с воздухом или кислородом. Скорость выхода жидкого газа в воздух всегда превышает скорость его сгорания. Поэтому исключается обратная вспышка в резервуарах, в независимости от наполнения.
Плотность пропана и бутана
Плотность пропана, бутана и всех других жидкостей и газов, как правило, зависит от давления и температуры. В случае с жидким газом также проводится различие между жидкой фазой и газовой фазой:
- пропан: 0,531 кг / л (жидкая фаза), 2,037 кг / м³ (газовая фаза),
- бутан: 0,597 кг / л (жидкая фаза), 2,66 кг / м³ (газовая фаза)
Как показывают эти значения плотности, бутан и пропан значительно тяжелее воздуха. Из-за более высокой плотности пропан или бутан, который вытекает из баллона, опускается и собирается в самой глубокой точке. Поэтому в целях безопасности сжиженный нефтяной газ в баллонах или резервуарах под давлением не должен храниться в помещениях ниже уровня земли.
Контейнеры и баллоны с жидким газом никогда не заполняются полностью. Это пустое пространство служит буфером, поскольку повышение давления в контейнере, полностью заполненном жидким газом, будет увеличивать давление на 7 бар при каждом градусе повышения температуры по Цельсию.
Пределы воспламенения пропана и бутана
Сжиженный газ, смешанный с воздухом, воспламеняется (становится взрывоопасным) только в определенных диапазонах концентраций. Пределы воспламенения представляют собой концентрацию сжиженного газа в воздухе, ниже или выше которой воспламенение не приводит к сгоранию.
Нижний и верхний пределы воспламенения:
- Пропан: от 2,1 до 9,5%;
- Бутан: от 1,5 до 10%.
Для сравнения – природный газ: от 4,4 до 16,5%.
На практике это означает высокую степень безопасности, поскольку воспламенение или дефлаграция могут иметь место только в этих узких пределах. Природный газ, а также многие технические газы имеют гораздо больший спектр горения, что означает, что при их хранении необходимо принимать дополнительные меры безопасности.
Точка кипения пропана и бутана
Когда жидкость нагревается, переход из жидкого в газообразное состояние происходит при определенной температуре, так называемой температуре кипения (которая зависит от давления). При атмосферных условиях, то есть 1013 миллибар, точка кипения для:
- Пропана -42,1 C;
- н-бутана -0,5 C.
Для сравнения: вода имеет температуру кипения +100 C.
В дополнение к н-бутану (нормальному бутану), существует также изобутан. Химическая формула для обоих газов C4H10. Температура кипения изобутана составляет около -11 С.
Давление пара
Давление пара или давление насыщения – это давление, при котором происходит переход из газообразного состояния в жидкое. Давление паров жидкого газа в закрытом контейнере зависит только от состава газа и температуры, а не от степени наполнения.
Если газ отбирается из контейнера со сжиженным газом, сжиженный газ пытается восстановить свое равновесное состояние путем повторного испарения фазы сжиженного газа. Давление падает только тогда, когда отводится больше жидкого газа, чем позволяет испарительная емкость контейнера.
Зачем смешивают пропан и бутан в автономной системе газоснабжения
Учитывая физико-химические характеристики насыщенных углеводородов, их применение во многом зависит от климатических условий. Сжиженный бутан в чистом виде не будет работать при отрицательных температурах. Тогда как применение чистого пропана противопоказано в условиях жаркого климата, поскольку высокая температура вызывает чрезмерное повышение давления в газовом резервуаре.
Так как для каждого региона нецелесообразно производить отдельную марку газа, с целью унификации ГОСТом предусмотрена смесь с определенным содержанием двух компонентов в рамках установленных норм. Согласно ГОСТ 20448-90 максимальное содержание бутана в данной смеси не должно превышать 60%, при этом для северных регионов и в зимнее время года доля пропана должно быть не меньше 75%.

Процентное соотношение газов в разное время года
Кстати, больше статей нашего блога о газификации — в этом разделе.
Химические свойства бутана:
Бутан трудно вступает в химические реакции. В обычных условиях не реагирует с концентрированными кислотами, расплавленными и концентрированными щелочами, щелочными металлами, галогенами (кроме фтора), перманганатом калия и дихроматом калия в кислой среде.
Химические свойства бутана аналогичны свойствам других представителей ряда алканов. Поэтому для него характерны следующие химические реакции:
- 1. каталитическое дегидрирование бутана:
CH3-CH2-CH2-CH3 → CH2=CH-CH2-CH3 + H2 (kat = Pt, Ni, Al2O3, Cr2O3, повышенная to).
- 2. галогенирование бутана:
CH3-CH2-CH2-CH3 + Br2 → CH3-CHBr-CH2-CH3 + HBr (hv или повышенная to);
CH3-CH2-CH2-CH3 + I2 → CH3-CHI-CH2-CH3 + HI (hv или повышенная to).
Реакция носит цепной характер. Молекула брома или йода под действием света распадается на радикалы, затем они атакуют молекулы бутана, отрывая у них атом водорода, в результате этого образуется свободный бутил CH3-CH·-CH3, который сталкиваются с молекулами брома (йода), разрушая их и образуя новые радикалы йода или брома:
Br2 → Br·+ Br· (hv); – инициирование реакции галогенирования;
CH3-CH2-CH2-CH3 + Br· → CH3-CH·-CH2-CH3 + HBr; – рост цепи реакции галогенирования;
CH3-CH·-CH2-CH3 + Br → CH3-CHBr-CH2-CH3 + Br·;
CH3-CH·-CH2-CH3 + Br· → CH3-CHBr-CH2-CH3; – обрыв цепи реакции галогенирования.
Галогенирование — это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атомы галогенируются в последнюю очередь). Галогенирование бутана проходит поэтапно – за один этап замещается не более одного атома водорода.
CH3-CH2-CH2-CH3 + Br2 → CH3-CHBr-CH2-CH3 + HBr (hv или повышенная to);
CH3-CHBr-CH2-CH3 + Br2 → CH3-CBr2-CH2-CH3 + HBr (hv или повышенная to);
и т.д.
Галогенирование будет происходить и далее, пока не будут замещены все атомы водорода.
- 3. нитрование бутана:
См. нитрование этана.
- 4. окисление (горение) бутана:
При избытке кислорода:
2C4H10 + 13O2 → 8CO2 + 10H2O.
При нехватке кислорода вместо углекислого газа (СО2) получается оксид углерода (СО), при еще меньшем количестве кислорода выделяется мелкодисперсный углерод сажа (в различном виде, в т.ч. в виде графена, фуллерена и пр.) либо их смесь.
- 5. сульфохлорирование бутана:
C4H10 + SO2 + Cl2 → C4H9-SO2Cl + … (hv).
- 6. сульфоокисление бутана:
2C4H10 + 2SO2 + О2 → 2C4H9-SO2ОН (повышенная to).
Что такое бутан?
Бутан – это так называемый сжиженный природный (нефтяной) газ, который получается при перегонке нефти.
Как и пропан, бутан по своей природе является газом, но это относится не ко всем горючим газам. Бутан становится жидким при -0,5 градусах Цельсия или ниже, в то время как пропан становится жидким только при -40 градусах Цельсия. Другим большим отличием между бутаном и пропаном является давление: при температуре 20 градусов Цельсия бутан имеет давление около 1,2 бар, тогда как пропан не менее 7,0 бар.
Оба изомера бутана являются газами при комнатной температуре, потому что (n-) бутан имеет температуру плавления -138 C и температуру кипения -0,5 C, а метилпропан (изобутан) имеет температуру плавления -160 C и температуру кипения −12 °С. Бутан практически не растворим в воде (90 мг / л). Оба изомера ведут себя схожим образом: они легко воспламеняются, не обесцвечивают бромную воду и раствор перманганата калия, подвергаются воздействию только галогенов хлора и брома под воздействием света.
Бутан (вещество)
Бутан имеет два изомера:
Физические свойства
Бутан — бесцветный горючий газ, со специфическим запахом, при нормальном давлении легко сжижаем от −0,5 °C, замерзает при −138 °C; при повышенном давлении и обычной температуре — легколетучая жидкость. Критическая температура +152 °C, критическое давление 3,797 МПа.
- Растворимость в воде — 6,1 мг в 100 мл (для н-бутана, при 20 °C), значительно лучше растворяется в органических растворителях). Может образовывать азеотропную смесь с водой при температуре около 100 °C и давлении 10 атм.
- Плотность жидкой фазы — 580 кг/м³
- Плотность газовой фазы при нормальных условиях — 2,703 кг/м³, при 15 °C — 2,550 кг/м³
- Теплота сгорания 45,8 МДж/кг (2657 МДж/моль (см.).
Нахождение и получение
Содержится в газовом конденсате и нефтяном газе (до 12 %). Является продуктом каталитического и гидрокаталитического крекинга нефтяных фракций. В лаборатории может быть получен по реакции Вюрца:
Сероочистка (демеркаптанизация) бутановой фракции
Прямогонную бутановую фракцию необходимо очищать от сернистых соединений, которые в основном представлены метил- и этил- меркаптанами. Метод очистки бутановой фракции от меркаптанов заключается в щелочной экстракции меркаптанов из углеводородной фракции и последующей регенерации щелочи в присутствии гомогенных или гетерогенных катализаторов кислородом воздуха с выделением дисульфидного масла.
Применение и реакции
При свободнорадикальном хлорировании образует смесь 1-хлор- и 2-хлорбутана. Их соотношение хорошо объясняется разницей в прочности связей С—Н в позиции 1 и 2 (425 и 411 кДж/моль).
При полном сгорании на воздухе образует углекислый газ и воду. Бутан применяется в смеси с пропаном в зажигалках, в газовых баллонах в сжиженном состоянии, где он имеет запах, так как содержит специально добавленные одоранты. При этом используются «зимние» и «летние» смеси с различным составом. Теплота сгорания 1 кг — 45,7 МДж (12,72 кВт·ч).
При недостатке кислорода образуется сажа, угарный газ или их смесь:
Фирмой DuPont разработан метод получения малеинового ангидрида из н-бутана при каталитическом окислении:
н-Бутан — сырьё для получения бутилена, 1,3-бутадиена, компонент бензинов с высоким октановым числом. Бутан высокой чистоты и особенно изобутан может быть использован в качестве хладагента в холодильных установках. Производительность таких систем немного ниже, чем фреоновых, но бутан безопасен для окружающей среды, в отличие от фреоновых хладагентов.
В пищевой промышленности бутан зарегистрирован в качестве пищевой добавки E943a, а изобутан — E943b, как пропеллент.
Биологические эффекты
Вдыхание бутана вызывает удушье и сердечную аритмию. При попадании на тело сжиженного газа или струи его испарений вызывает охлаждение до −20 °C, что крайне опасно при ингаляциях.
Технические характеристики
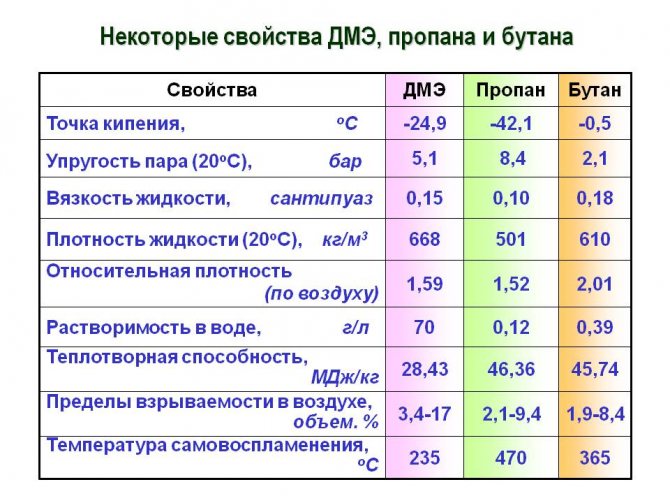
На вопрос: «Каким образом химические и физические свойства связаны с техническими особенностями этой смеси?», стоит рассматривать все возможные варианты ответов.
- Во-первых, благодаря своему высокому давлению «удержания» в жидком состоянии, этот газ слишком инертный. То есть легко поддается переходу из жидкого состояния в газообразное.Это очень полезная особенность на производствах, где это является крайней необходимостью.
- Во-вторых, низкая температура кипения и замерзания делает пропан-бутановую смесь стойкой к «столкновениям» с веществами азотного происхождения. Следовательно, гарантирует ей безопасность от замерзания и кипения.
- Ну и, конечно же, стоит отметить высокую температуру горения пропана, без которой его польза была бы не столь существенной для достижения определенных бытовых или производственных целей.
Технические характеристики
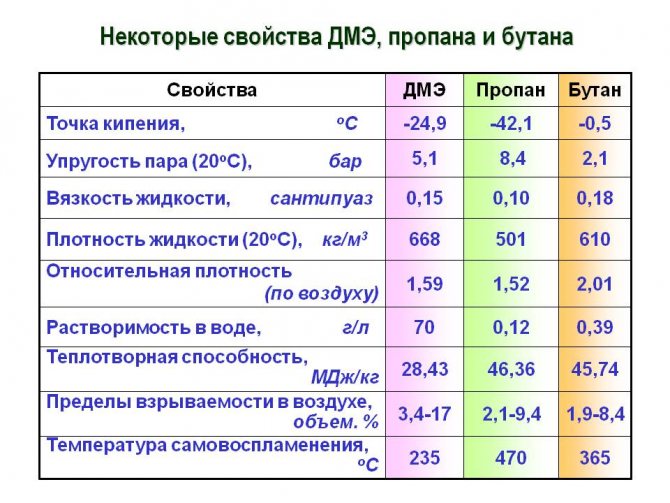
На вопрос: «Каким образом химические и физические свойства связаны с техническими особенностями этой смеси?», стоит рассматривать все возможные варианты ответов.
- Во-первых, благодаря своему высокому давлению «удержания» в жидком состоянии, этот газ слишком инертный. То есть легко поддается переходу из жидкого состояния в газообразное.Это очень полезная особенность на производствах, где это является крайней необходимостью.
- Во-вторых, низкая температура кипения и замерзания делает пропан-бутановую смесь стойкой к «столкновениям» с веществами азотного происхождения. Следовательно, гарантирует ей безопасность от замерзания и кипения.
- Ну и, конечно же, стоит отметить высокую температуру горения пропана, без которой его польза была бы не столь существенной для достижения определенных бытовых или производственных целей.
Ссылки [ править ]
- ^
- Хофманн, Август Вильгельм Фон (1 января 1867 г.). «I. О действии трихлорида фосфора на соли ароматических монаминов». Труды Лондонского королевского общества . 15 : 54–62. DOI . S2CID .
- ^ «Передний вопрос». Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга) . Кембридж: Королевское химическое общество . 2014. с. 4. DOI . ISBN
- WB Kay (1940). «Соотношение давление-объем-температура для н-бутана». Промышленная и инженерная химия . 32 (3): 358–360. DOI .
- . США: Matheson Tri-Gas Incorporated. 5 февраля 2011 года Архивировано из на 1 октября 2011 года . Проверено 11 декабря 2011 года .
- . www.chem.qmul.ac.uk .
- Уоттс, Х. (1868). Словарь по химии . 4 . п. 385.
- Maybery, CF (1896). «О составе серных нефтей Огайо и Канады». Труды Американской академии искусств и наук . 31 : 1–66. DOI . JSTOR .
- (2009). «Разница энтальпии между конформациями нормальных алканов: исследование спектроскопии комбинационного рассеяния н- пентана и н- бутана». J. Phys. Chem. . 113 (6): 1012–9. DOI . PMID .
- . houstonchronicle.com . 21 июня 2016 . Проверено 20 сентября 2018 года .
- . Сканк Фарм Исследования . 2013-08-26 . Проверено 5 декабря 2019 .
- . thcfarmer.com. 19 Декабрь 2009 . Дата обращения 3 октября 2016 .
- Филд-Смит М., Бланд Дж. М., Тейлор Дж. С. и др. . Департамент общественного здравоохранения. Лондон: Медицинская школа Святого Георгия. Архивировано из 27 марта 2007 года.
- ^ Рэмси Дж., Андерсон Х.Р., Блур К. и др. (1989). «Введение в практику, распространенность и химическую токсикологию злоупотребления летучими веществами». Hum Toxicol . 8 (4): 261–269. DOI . PMID . S2CID .
- Басс М. (1970). «Внезапная нюхательная смерть». JAMA . 212 (12): 2075–2079. DOI . PMID .
Здоровье и безопасность окружающей среды
Бутадиен обладает низкой острой токсичностью. ЛК50 составляет 12,5–11,5 об.% При вдыхании крысами и мышами.
Длительное воздействие было связано с сердечно-сосудистыми заболеваниями. Существует постоянная связь с лейкемией, а также значительная связь с другими видами рака.
МАИР определило 1,3-бутадиен как канцероген группы 1 («канцерогенный для человека»), а Агентство по регистрации токсичных веществ и Агентство по охране окружающей среды США также включили это химическое вещество в список канцерогенов. Американская конференция государственных промышленных гигиенистов (ACGIH) перечисляет это химическое вещество как предполагаемый канцероген. Совет по защите природных ресурсов (NRDC) перечисляет некоторые группы заболеваний, которые предположительно связаны с этим химическим веществом. Некоторые исследователи пришли к выводу, что это самый сильный канцероген в сигаретном дыме , вдвое более мощный, чем акрилонитрил, занявший второе место.
1,3-Бутадиен также является предполагаемым тератогеном человека . Продолжительное и чрезмерное воздействие может повлиять на многие участки человеческого тела; кровь, мозг, глаза, сердце, почки, легкие, нос и горло — все они реагируют на присутствие избыточного 1,3-бутадиена. Данные на животных показывают, что женщины имеют более высокую чувствительность к возможным канцерогенным эффектам бутадиена по сравнению с мужчинами при воздействии этого химического вещества. Это может быть связано с воздействием рецепторов эстрогена. Хотя эти данные показывают важные последствия для рисков воздействия бутадиена на человека, для окончательной оценки рисков необходимо больше данных. Также отсутствуют данные о воздействии бутадиена на репродуктивную функцию и развитие у мышей, но исследования на животных показали, что вдыхание бутадиена во время беременности может увеличить количество врожденных дефектов, а у людей такие же гормональные системы, как и у животных.
Основные физико-химические свойства компонентов СУГ и продуктов их сгорания
К основным характеристикам СУГ относят:
- температуру испарения/конденсации;
- температуру воспламенения;
- теплоту сгорания;
- плотность;
- объемное расширение.
Важными характеристиками являются пределы взрываемости при смешении с воздухом, быстрота распространения огня при горении, условия для полного сгорания.
Температура испарения/конденсации
При нормальном давлении составляет:
- для пропана – минус 42 °C;
- для бутана – минус 0,5 °C.
Если температура газов поднимается выше этих значений, они начинают испаряться, при опускании ниже – конденсироваться. Как правило, сжиженный газ поставляется в форме смеси (бутан+пропан). Поэтому фактическая температура испарения/конденсации зависит от их соотношения.
Обычно газ, поставляемый зимой, сохраняет испаряемость до минус 20 °C. Но иногда производитель поставляет смесь с повышенным количеством бутана. Это приводит к тому, что даже при небольшом понижении температуры ниже нуля газ перестает испаряться.
Температура воспламенения
Она равна:
- для пропана – от 504 до 588 °C;
- для бутана – от 430 до 569 °C.
При этих значениях температуры газ может воспламениться даже при отсутствии открытого огня – если имеются предметы, которые нагреты до высокой температуры, но еще не светятся.
Теплота сгорания
Этот параметр характеризует количество тепла, выделяемое при сгорании 1 м3 газа. Он равен:
- для пропана – 22…24 тыс. ккал. (91…99 МДж/ м3);
- для бутана – 28…31 тыс. ккал. (118…128 МДж/ м3).
Пределы взрываемости
Это очень важная с точки зрения безопасности характеристика. При определенном соотношении смесь газов с воздухом или кислородом может взрываться. Вероятность взрыва зависит от скорости распространения огня. Чем она выше, тем опаснее ситуация. В свою очередь скорость распространения огня зависит от пропорции газов. Нужно иметь в виду, что при увеличении температуры границы взрываемости расширяются.
При смешении газа с воздухом он становится взрывоопасным при следующих соотношениях:
- пропан – 2,1%…9,5%;
- бутан – 1,5%…8,5%;
- смесь – 1,5%…9,5%.
Плотность
Плотность газообразной фазы в норме составляет:
- пропана – 2,019 кг/ м3;
- бутана – 2,703 кг/ м3.
Плотность жидкой фазы – 0,5…0,6 кг/л.
Как видим, пары СУГ весят больше воздуха, плотность которого равна 1,29 кг/м3. Это приводит к тому, что при утечках газ собирается внизу помещения, где в относительно малом количестве может образовать с воздухом взрывоопасную смесь. Визуально это может быть похоже на дымку или стелющийся туман. При утечках из подземных коммуникаций и емкостей СУГ заполняют непроветриваемые углубления, подвалы, канализационные колодцы и остаются там довольно долго. Визуально обнаружить утечки трудно. Не выходя на поверхность, они растекаются под землей на довольно большие расстояния.
Объемное расширение
Объемное расширение жидкой фазы в 16 раз выше, нежели у воды. Это создает опасность разрыва баллона при увеличении температуры.
Степень сгораемости
Чтобы газ сгорал полностью, на 1 м3 его паров должно приходиться:
- для пропана – 24 м3 воздуха или 5,0 м3 О2;
- для бутана – 31 м3 воздуха или 6,5 м3 О2.
При испарении 1 кг жидкого газа образуется:
- пропана – 0,51 м3 паров;
- бутана – 0,386 м3 паров.
При испарении 1 л газа образуется:
- пропана – 0,269 м3 паров;
- бутана – 0,235 паров м3.
Скорость распространения огня
Пламя горящего бутана распространяется с максимальной скоростью 0,826 м/сек, пропана – 0,821 м/сек.
Цвет и запах
Чистые СУГ бесцветны и лишены запаха. Это создает опасность неконтролируемых утечек с последующим образованием взрывоопасных смесей. Чтобы облегчить своевременное обнаружение утечек, СУГ подвергают одоризации (приданию запаха) техническим этилмеркаптаном.
Чистый н-бутан
Чистый н-бутан при 100 С в присутствии А1С1з не подвергается изомеризации. Но достаточно ввести в смесь 2 43 % бутиленов, как начнется изомеризация бутана с образованием в равновесной смеси до 45 % изобутана.
Чистый н-бутан при 100 С в присутствии А1С1з не подвергается изомеризации. Но достаточно ввести в смесь 2 43 % бутиленов, как начинается изомеризация бутана с образованием в равновесной смеси до 45 % изобутана.
Химически чистый н-бутан содержал менее 0 2 / 0 изобутана и менее 0 01 % олефинов. В дальнейшем он очищался от олефина пропусканием над гранулированным хлористым алюминием при комнатной температуре, под атмосферным давлением с объемной скоростью, равной единице.
|
Схема лабораторной хроматографической установки для выделения бутенов. |
Для выделения чистого н-бутана, изобутена, транс-бу-тена — 2, гыс-бутена-2 и бутадиена лучшим оказался носитель ИНЗ-600 фракции 0 5 — 1 мм, обработанный 30 % эфира ТЭГНМ.
Пайнз и Уокер показали, что изомеризация чистого н-бутана в присутствии А1С13 НС1 не происходит без прибавления олефинов ( или другого источника карбониевых ионов), если только при самой изомеризации не образуются олефины или подобные им вещества.
Пайнс и Уоккер , Облад и Горин показали, что очень чистый н-бутан при полном отсутствии олефина или кислорода не изомеризуется каталитической системой хлористый алюминий — хлористый водород, по-видимому, потому, что ион карбония в отсутствие олефина не образуется. Но изомеризации не происходит, если те же самые парафины контактируют с более устойчивыми кислыми материалами, например глиноземом, которые являются намного более слабыми кислотами. Однако, если на глинозем нанести небольшое количество платины, катализатор становится очень активным и действует селективно в отношении изомеризации парафина.
Первой стадией процесса является выделение и очистка бу-тиленов, а также получение практически чистого н-бутана, возвращаемого на дегидрирование. Катализат дегидрирования н-бутана компримируется и из него удаляются водород и низкокипящие примеси.
Первой стадией процесса является выделение и очистка бу-тиленов, а также получение практически чистого н-бутана, возвращаемого на дегидрирование.
Помимо введения алкенов и алкилгалогенидов в реакционную смесь имеются и другие способы промотировать изомеризацию чистого н-бутана. Эти методы, по-видимому, основаны на непрямом введении алкенов или алкилгалогенидов в реакционную смесь. Сопровождающий изомеризацию крекинг, вероятно, ведет к образованию алкенов или карбоний-ионов. Кислород расходуется в этом процессе. Это может быть объяснено двояко: а) по одному из возможных механизмов кислород окисляет бутан в бутильный карбоний-ион; б) кислород взаимодействует с галогенидом алюминия, в результате чего образуется некоторая форма оксигалогенида и галоид, который реагирует с н-бутаном и дает бутилгалогенид.
|
Схема установки для очистки — бутана. |
Дьюара со смесью сухого льда с ацетоном ( температура около-35 С); 6 — предохранительная склянка; 8, 14 — банк с ледяной водой; IS — пустая склянка; IS-змеевиковый конденсатор; 17-сосуд Дьюара; / — приемник чистого н-бутана; I-V1 — краны.
Мабери и Худсон были, пожалуй, первыми исследователями, занявшимися изучением хлорирования я-бутана. Они хлорировали почти чистый н-бутан и получили, по их сообщению, только монохлорид, кипящий при температуре 68 — 69 С.
Роберте и Хамилл облучали смеси w — бутана и циклогексана. Выходы метана, измеренные для чистого н-бутана и смесей, содержащих 10 и 20 об. % цикло — СеН, составили 0 20; 0 09 и 0 03 соответственно.
Подготавливают прибор к работе, нагревают печь хроматермографа № 5 до температуры в максимуме 100 С и устанавливают ее в исходном верхнем положении. Устанавливают определенную скорость потока газа-носителя и наносят порцию чистого н-бутана или его смеси с воздухом. Устанавливают заданную скорость движения печи и включают механизм, опускающий ее вниз. Следят за температурой и выходом н-бутана. В момент достижения максимума пика н-бутана измеряют температуру, при которой происходит его десорбция, и полученное значение записывают.
О стране Бутан



Бутан красочно-сказочная страна, ставшая лишь недавно доступная для посещения.
Столица Бутана?
Главным городом страны Бутан является Тхимпху. Этот город самый большой в королевстве Бутан. Столицей он стал ещё с далёких времён. Тхимпху расположился на западном побережье речушки Чингу. Обитателей города насчитывают 100 тысяч человек. В этом городе располагается колоссальная часть отелей страны. Туристы посещают город во время осеннего фестиваля Цечу.
Государственный язык?
Государственным языком Бутана является дзонг-кэ. В этой стране подсчитали 25 языков на которых разговаривают. А также местные жители разговаривают на многих диалектах. Вообще Бутанский язык не имеет определённой классификации так, как его деление очень многозначно. Существуют лишь основные из них: Дзала-кха, Бумтанг-кха, Цхангла, Дзала-кха.
Валюта?
В Бутане национальной валютой является нгултрум. Эта валюта относится у индийской рупии. Но также используется американские доллары.
Климат?
| Месяцы | Январь | Февраль | Март | Апрель | Май | Июнь |
| Температура воздуха (день)°С | 3.1 | 3.8 | 12.3 | 18.7 | 24.5 | 28.5 |
| Температура воздуха (ночь)°С | -1.5 | -1.6 | 4.5 | 8.1 | 12.0 | 15.1 |
| Температура воды (моря) °С | 37.7 | 27.8 | 29.5 | 45.2 | 43.6 | 30.8 |
| Месяцы | Июль | Август | Сентябрь | Октябрь | Ноябрь | Декабрь |
| Температура воздуха (день)°С | 32.0 | 31.8 | 25.8 | 18.7 | 11.3 | 3.4 |
| Температура воздуха (ночь)°С | 17.9 | 17.8 | 14.1 | 10.2 | 5.4 | -1.0 |
| Температура воды (моря) °С | 9.2 | 5.8 | 31.3 | 14.7 | 18.9 | 22 |
В какое время года лучше посещать страну?
Хорошее время для отдыха в Бутане турист может определить сам, исходя от Ваших вожделений и мечтаний. Если планировать своё путешествие для просмотра удивительных мест, то в Бутан можно отправится с сентября по конец ноября или с марта по май.
Политическая обстановка?
В Бутане немного неустойчивая политическая обстановка. Задняя часть этой страны находится в Гималайском поясе, а там конфликтуют Индия и Пакистан.
Религиозная принадлежность населения?
В стране Бутан преобладает буддизм. Там находится последний бастион Махаянской школы. Эта официальная религия страны и поэтому там ежегодно проводятся обычаи и фестивали. Для индусов имеются школы вайшнавизма, шактизма и шайвизма, пураны. В Южной части страны Бутана располагаются индуистские храмы. Обычно индусы признают свою религию небольшими группами.
Таможенные нормы и правила?
В Бутане существуют определённые законы на таможни. Экспорт и импорт валюты национальной строго не допускается. На пограничном пункте абсолютно весь багаж подвергается контролю. Не допускается ввоз наркотических веществ, огнеприпасов, оружия, антиквариата, растений и животных, и товаров из шкур и панцирей.
Виза?
Отправляясь в увлекательное путешествие в страну Бутан, то Вам необходимо зарегистрировать визу. Не все туристы смогут её получить, а лишь те, кто имеет аккредитацию прибутанском Департаменте туризма. Можно также отправится в Бутан по определённому пригласительному от Бутановских промышленных компаний.
Основные достопримечательности?
При посещении Бутана нужно посетить город Паро. Это главный плодородный городок Бутана. Плодородная долина значится уникальными пейзажами и колоритными деревнями. Невозможно проехать мимо курортного посёлка Кьичу. Ведь там распространилось изобилие речушек и горных рек. Страна Бутан располагают Национальным парком Чёрных Гор. В нём под охраной находится черношейные цапли, чёрные гималайские медведи, красные лисы и снежные барсы.
Праздники и фестивали?
В Бутане существует существенное количество торжеств. Большую часть составляют религиозные фестивали. Количество фестивалей постоянно меняется, также изменяет и даты их проведения. Самые сочные и яркие фестивали «тсечу» отмечаются в монастырях. (Раз в год, в весенний или осенний период). Эти фестивали продолжаются на протяжении 5 дней, и они содержат в себе всяческие танцы и театрализованными представления.
Национальная кухня?
Особенность национальной кухни Бутана упрощена. Она представляет собой традиции соседних стран. Самым доминирующим ингредиентом является рис. Его приготовляют в самых разных сочетаниях. Рис смешивают с овощами, поливают его всячески соусом, добавляют шафран и делают различные другие соединения.Также в Бутане местные жители любят добавлять перец «чили» в разных соединениях с маслицем, зеленью и соусом. Самым популярным компонентом бутанских блюд является сыр. Его добавляют в различные кушанья. О том, что Бутан удивительная страна уже было оговорено.
Ситуация с преступностью?
Преступность в стране совсем мизерная. Здесь люди очень щедры и полностью поглощены в религию. В Бутане у обитателей есть небольшое затруднение с выпивкой и наркотикосодержащими веществами.



Главное отличие — бутан против изобутана
Бутан является органическим соединением. Эта молекула может быть найдена в нескольких формах, известных как изомеры. Изобутан является структурным изомером бутана. И бутан, и изобутан являются газообразными углеводородными соединениями. Они являются углеводородами, потому что эти соединения состоят только из атомов C и H. И бутан, и изобутан имеют одинаковую химическую формулу: C4ЧАС10, Следовательно, они имеют одинаковые значения молярной массы. Эти соединения являются легковоспламеняющимися и, следовательно, могут быть использованы в качестве топлива для сжигания. Основное различие между бутаном и изобутаном заключается в том, что бутан может быть линейной или разветвленной молекулой, тогда как изобутан по существу является разветвленной молекулой.
Ключевые области покрыты
1. Что такое бутан — Определение, свойства и приложения2. Что такое изобутан — Определение, свойства и приложения3. Каковы сходства между бутаном и изобутаном — Краткое описание общих черт4. В чем разница между бутаном и изобутаном — Сравнение основных различий
Ключевые термины: бутан, топливо, изобутан, изомеры, углеводород